Los elementos químicos se pueden combinar entre sí de diferentes maneras para formar gran variedad de compuestos. Las combinaciones más sencillas son aquellas en las que participan solo dos elementos distintos: los compuestos binarios. Entre ellos, por ejemplo, se encontraría el agua (formada por oxígeno e hidrógeno), la sal común (que se obtiene por la unión de átomos de cloro y de sodio) o el benceno (anillo de átomos de carbono enlazados a hidrógenos).
¿Cómo representamos los compuestos?
Cada compuesto se caracteriza por la proporción que hay entre los átomos de sus elementos constituyentes, que se representa mediante su fórmula química:
- Las fórmulas empíricas ofrecen la relación más sencilla en la que se encuentran los átomos en un compuesto.
- Las fórmulas moleculares indican el número de átomos que forman parte de cada molécula (cuando el compuesto es molecular).
- Las fórmulas estructurales informan sobre la distribución de los átomos y los enlaces que se establecen entre ellos.
Analicemos las diferencias entre ellas:
- En el agua la cantidad de hidrógenos es el doble que la de oxígenos, por lo que su fórmula empírica es H2O. Como el agua está formada por moléculas discretas, cada una de las cuales contiene dos átomos de hidrógeno y un átomo de oxígeno, su fórmula molecular coincide con la anterior. Los enlaces covalentes entre hidrógeno y oxígeno quedan patentes en su fórmula estructural:
![]()
- En la sal común la cantidad de sodio es la misma que la de cloro, por lo que su fórmula empírica sería NaCl. Este no es un compuesto molecular, es decir, no se puede decir que en realidad existan moléculas individuales de sodio y cloro, sino que estos átomos se apilan de manera ordenada formando una estructura mucho mayor, conocida como red cristalina:

- En el benceno, el número de átomos de carbono coincide con el de átomos de hidrógeno, por lo que su fórmula empírica sería CH. Este sí es un compuesto molecular, y al estudiarlo, comprobamos que en cada molécula hay seis átomos de carbono y seis átomos de hidrógeno, por lo que su fórmula molecular es C6H6 (en este caso no coincide con la empírica, sino que es un múltiplo de ella, pero la relación de átomos es la misma). Los átomos de carbono se unen entre sí formando un anillo hexagonal, y cada uno se enlaza a un hidrógeno, lo cual aparece reflejado en su fórmula estructural:

La fórmula estructural aporta mucha más información, lo que resulta especialmente útil en moléculas orgánicas (como el benceno) o de estructura compleja. Pero este no es el caso que nos ocupa ahora, por lo que nos bastará con conocer la fórmula molecular de un compuesto (o la empírica, en su defecto) para poder nombrarlo o identificarlo.
¿Cómo obtenemos la fórmula de un compuesto?
En la fórmula de un compuesto se representan los elementos que lo forman mediante sus respectivos símbolos, y el número de átomos de cada uno mediante un subíndice. Para formular un compuesto binario debemos tener en cuenta, fundamentalmente, dos cosas:
- ¿Qué elemento va en primer lugar en la fórmula?
- ¿Qué subíndice le corresponde a cada elemento?
Para responder a la primera pregunta, seguiremos las actuales recomendaciones de la IUPAC, que propone la siguiente secuencia de elementos, basada en consideraciones de electronegatividad, en la que la flecha hace un recorrido que parte del elemento menos metálico y continúa hacia el elemento más metálico (finalizando con los gases nobles):
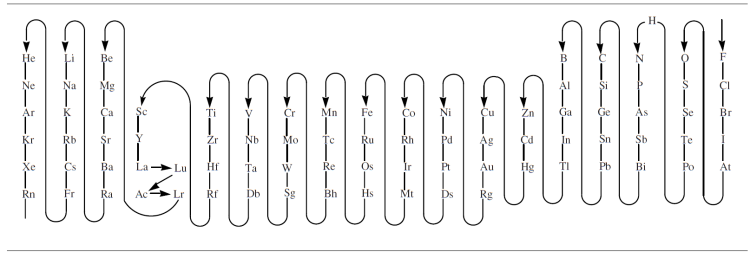
En las fórmulas de los compuestos binarios, el elemento que se encuentre el último al seguir la flecha, se representa el primero en la fórmula.
Los elementos se ordenan en una fórmula empezando por el más metálico (menos electronegativo) y terminando por el menos metálico (más electronegativo).
Aunque a grandes rasgos la electronegatividad varía de esta manera, no es una coincidencia exacta. La IUPAC intenta simplificar el recorrido al ir de grupo en grupo, y de arriba a abajo. Solamente el hidrógeno tiene una posición única. Esto significa que el oxígeno, que anteriormente disfrutaba de un estatus especial, recibe ahora la misma consideración que los demás elementos y aparece en la secuencia en la posición que le corresponde por su situación en la tabla periódica (antes el oxígeno se solía situar al final, por tener una electronegatividad solo superada por el flúor).
Con respecto a la segunda pregunta, para asignar los subíndices adecuados a cada elemento, debemos tener en cuenta que la suma de los números de oxidación en una sustancia neutra siempre es nula (si fuese un ion sería su carga). En un compuesto binario, el número de oxidación del elemento más electronegativo debe ser compensado con el número de oxidación del elemento más electropositivo. Si ambos son iguales, pero de signo opuesto, no hay problema (su suma es cero), y en la fórmula sólo aparecería un átomo de cada elemento. Sin embargo, cuando los números de oxidación no coinciden, debemos compensarlo variando el número de átomos hasta que el valor de ambos se iguala. La estrategia general consiste en añadir tantos átomos de un elemento como indique el número de oxidación del otro.
Veamos algunos ejemplos:
- Una combinación binaria de calcio y azufre. El número de oxidación del calcio es II, y el del azufre, –II. Como ambos coinciden, en la fórmula solo debemos incluir un átomo de cada para que la suma sea cero, por lo que, respetando el orden que les corresponde, la fórmula sería: CaS.
- Una combinación binaria de aluminio y oxígeno. El aluminio, más electropositivo, tendría número de oxidación III. Por su parte, el oxígeno, más electronegativo, actuaría con número de oxidación –II. Con dos átomos de aluminio y tres de oxígeno conseguiríamos empatar los números de oxidación, y la fórmula resultante sería: Al2O3.
¿Cómo se nombra un compuesto a partir de su fórmula?
Al igual que ocurría con las fórmulas, también existen diferentes tipos de nombres, y cada uno aporta una información distinta de la molécula:
- Los nombres de composición indican únicamente la cantidad de átomos de cada elemento en el compuesto. Dan poca información de cómo se distribuyen los átomos en la molécula.
- Los nombres de sustitución se basan en el nombre de un compuesto de partida (progenitor), en el que se han sustituido algunos átomos por otros (derivado). Inspirados en la nomenclatura orgánica, dan bastante información sobre la estructura de la molécula.
- Los nombres de adición se forman a partir del nombre del átomo central al que se van añadiendo los átomos con los que se enlaza. Da mucha información sobre la estructura de la molécula.
Aunque los nombres de composición son los que menos información estructural ofrecen, son los que vamos a utilizar casi de manera exclusiva. El uso de nombres de sustitución y de adición requiere tener ciertos conocimientos de los compuestos y la manera en que se enlazan sus átomos, por lo que pueden ser muy útiles cuando se especializa el estudio, pero no en los cursos iniciales y, mucho menos, en las primeras tomas de contacto con la nomenclatura inorgánica.
El tipo de nombre de composición más sencillo es un nombre estequiométrico, que es solamente el reflejo de la fórmula empírica o molecular del compuesto.
En los compuestos binarios se cita primero el elemento situado a la derecha en la fórmula, añadiendo el sufijo –uro a la raiz de su nombre, y a continuación el nombre del elemento situado a la izquierda en la fórmula, con la preposición «de» entre medias.
Nótese que el elemento situado a la izquierda es, por convenio, más electronegativo, y por ello se nombra como si se tratase de un anión, por lo que el elemento situado a la derecha, más electropositivo, se consideraría un catión. Esto hace pensar que el enlace tiene una naturaleza iónica, lo cual no siempre se corresponde con la realidad.
Por ejemplo, el nombre estequiométrico del compuesto de fórmula NaCl es cloruro sódico (sal común) y el del CaS es sulfuro de calcio. Solo el oxígeno se mantiene como excepción, y cuando va situado al final de la fórmula se le nombra como óxido, por lo que el compuesto MgO no es oxigenuro de calcio, sino óxido de calcio.
Cuando las proporciones de los elementos en la fórmula no son las mismas, pueden indicarse de diferentes maneras:
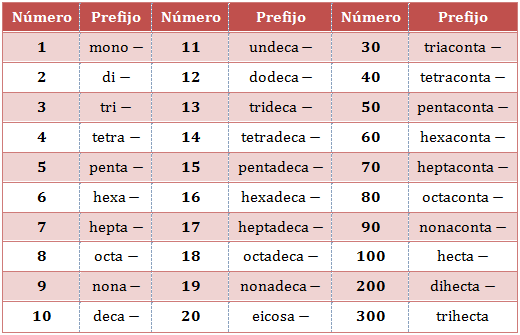
- Mediante prefijos multiplicadores (mono–, di–, tri–, tetra–, penta–…) para indicar el número de átomos de cada elemento (antes llamada nomenclatura sistemática). Por ejemplo, el nombre para el Al2O3 es trióxido de aluminio. El prefijo mono– es superfluo, y solo se debe utilizar en los casos en que convenga distinguir un compuesto de otro con los mismo elementos, como ocurre con el monóxido de carbono (CO) y el dióxido de carbono (CO2).
- Indicando el número de oxidación pertinente entre paréntesis (y en números romanos) inmediatamente después del nombre, sin dejar un espacio (antigua nomenclatura de Stock). Esto solo es necesario cuando el elemento tiene posibilidad de actuar con más de un número de oxidación, por ejemplo, en el óxido de aluminio (Al2O3) no sería necesario (el aluminio solo puede tener número de oxidación III) pero sí en los compuestos de hierro: cloruro de hierro(II) para el FeCl2 o cloruro de hierro(III) para el FeCl3.
- Indicando el número de carga, de la misma manera que el anterior, pero en números arábigos y con el signo correspondiente (número de Ewens-Bassett). Como ocurre con los números de oxidación, solo se indica cuando es necesario: hidruro de plomo(2+) o hidruro de plomo(4+), para los compuestos PbH2 y PbH4, respectivamente.
Estos criterios son de aplicación general en todos los compuestos binarios, aunque suele clasificarse su estudio por grupos de compuestos, por lo que es conveniente prestar atención a las particularidades de cada uno de ellos, pues en ciertos casos se recomiendan otros nombres o se aceptan otras nomenclaturas.
